Comentario a la Sentencia de Tribunal Supremo de 20 de octubre de 2017
Introducción
Por su evidente importancia económica, los efectos que tiene el Acuerdo sobre los Aspectos de los Derechos de Propiedad Intelectual relacionados con el Comercio (en adelante, “ADPIC”) sobre la protección jurídica de las invenciones químicas y farmacéuticas ha hecho correr ríos de tinta y ha generado no pocos conflictos.
Diversas de las cuestiones que el Acuerdo plantea en relación con la protección de estas invenciones mediante patente o a través de un certificado complementario de protección para los medicamentos han quedado zanjadas tras la sentencia del TJUE de 18 de julio de 2013 y los dos autos del mismo tribunal de 30 de enero de 2014.
La Sentencia de Tribunal Supremo de 20 de octubre de 2017 aborda uno de los supuestos en los que la aplicación del ADPIC acaso pudieran suscitar algunas dudas: los certificados complementarios de protección que tienen una patente de base solicitada antes de la entrada en vigor del ADPIC pero concedida con posterioridad a la fecha de su aplicación.
Los hechos del caso
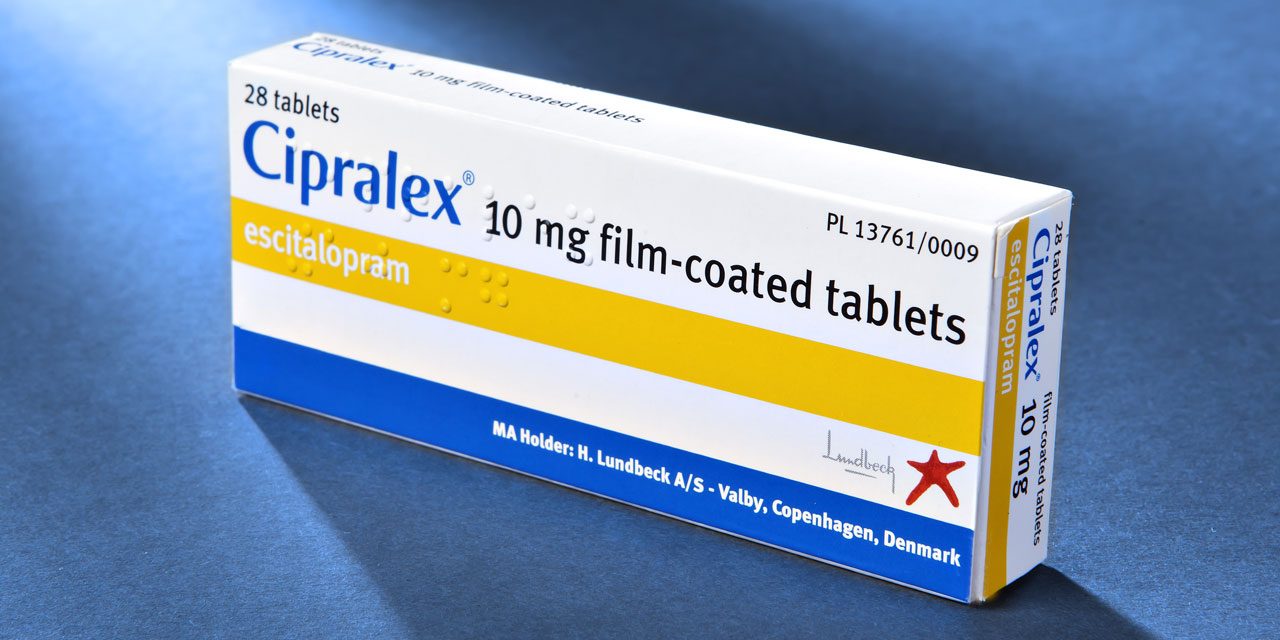
Lundbeck, A/S (en adelante, Lundbeck) solicitó el 1 de junio de 1989 una patente europea EP0347066 (EP 066), con un juego de reivindicaciones específicas para España, que fue concedida el 15 de marzo de 1995 y publicada en la primera traducción al español del folleto de la misma, el 1 de mayo del mismo año. En esa versión original, la patente ES 891, no contenía reivindicaciones de producto y tenía por objeto era un procedimiento para la obtención del principio activo escitalopram (un agente indicado para el tratamiento de la depresión y de diversos trastornos mentales). La fecha de su caducidad era de 1 de junio de 2009. Sobre la base de esa patente, Lundbeck, solicitó y obtuvo, posteriormente, (el 16 de abril de 2004) un Certificado Complementario de Protección, cuya validez se extendía hasta 1 de junio de 2014.
Con anterioridad a esa solicitud y, en concreto, el 24 de agosto de 2006, Lundbeck había depositado ante la Oficina Española de Patentes y Marcas (OEPM), una traducción revisada del folleto de la patente EP 066 que incorporaba las reivindicaciones de producto que no se habían incluido en la traducción original. Tras ser denegada la solicitud y recurrida en diversas instancias su resolución, la OEPM publicó, en ejecución de la sentencia de Tribunal Supremo – Sala 3ª- de 16 de septiembre de 2011, la traducción revisada de la patente EP 066, con el mismo número que el de la patente española 891.
Tras tener conocimiento de que diversas empresas farmacéuticas comercializaban en España medicamentos genéricos que contenía el principio activo escitalopram, cuya autorización de comercialización fue obtenida antes de publicarse la traducción revisada de dicha patente, Lundbeck interpuso demanda contra las mismas por infracción del Certificado Complementario de Protección antes referido. El argumento desenvuelto para sustentar su demanda estribó en que tales empresas habían invadido el ámbito de protección del Certificado o iban a hacerlo de forma inminente al explotar o haber realizado actos preparatorios para explotar los medicamentos genéricos que contenía el principio activo escitalopram, por cuanto que éstos infringían la patente ES 891 y, con ello, el Certificado Complementario titularidad de Lundbeck. A ello, esta última compañía, acumuló acción por competencia desleal.
El Juzgado de lo Mercantil de Barcelona desestimó la demanda. La actora apeló y la Audiencia Provincial de Barcelona (Secc. 15ª) confirmó el pronunciamiento del tribunal a quo. La sentencia de Tribunal Supremo de 20 de octubre de 2017 desestima íntegramente los recursos interpuestos por Lundbeck.
Doctrina de la sentencia
La doctrina establecida por la sentencia que comentamos, por lo que a las cuestiones sustantivas se refiere, se resume en la siguiente idea: La doctrina del TJUE contenida en la sentencia de 18 de julio de 2013 y en los dos autos de 30 de enero de 2014 es de aplicación a las patentes europeas solicitadas con anterioridad a la entrada en vigor del ADPIC pero concedidas con posterioridad que fueron validadas en España mediante la publicación de un pliego de reivindicaciones de procedimiento, si el solicitante, a pesar de que el artículo 70.7 del ADPIC le legitimaba para cambiar ese pliego de reivindicaciones y sustituirlas por las reivindicaciones de producto solicitadas para el resto de los países, no hizo uso de la facultad.
En consecuencia, el Acuerdo ADPIC y, en particular, sus artículos 27.1 y 70.2, no permiten extender la protección que confiere una patente de esas características a las reivindicaciones de producto.
A ello cabe añadir, por su relevancia, el hecho de que el Tribunal rechazase formular al TJUE una cuestión prejudicial para que determinase si su doctrina establecida en la sentencia de 18 de julio de 2013 y en sus dos autos de 30 de enero de 2014 era aplicable también a los comprendidos en el artículo 70.7 del ADPIC.
Análisis
La Sentencia de Tribunal Supremo de 20 de octubre de 2017 versa sobre las implicaciones que se siguen de aplicar las disposiciones del ADPIC a los certificados complementarios de protección para los medicamentos creados por el Reglamento (CEE) nº 1768/92 del Consejo, de 18 de junio de 1992, relativo a la creación de un certificado complementario de protección para los medicamentos [en adelante “el Reglamento (CEE) nº 1768/92”], que estaba en vigor en la fecha en la que fue concedido el certificado en litigio [para el actual v. Reglamento (CE) nº 469/2009 del Parlamento Europeo y del Consejo, de 6 de mayo de 2009], que tienen una patente de base solicitada antes de la entrada en vigor del ADPIC pero concedida con posterioridad a la fecha de su aplicación.
En concreto, la cuestión de fondo que el tribunal hubo de dilucidar fue si la traducción revisada del folleto de la patente europea, que pasó a incorporar las reivindicaciones de producto de las que carecía la original, podía válidamente ampliar el ámbito de protección de la patente de base del certificado complementario de protección de la actora y, por tanto, de este último (en cuyo caso, de ser la respuesta afirmativa, la comercialización de los medicamentos genéricos controvertidos lo infringirían).
Antes de abordar esta cuestión, y con el fin de facilitar su comprensión, explicaremos en apretada síntesis algunos extremos que son claves para entender el tema debatido.
Los certificados complementarios de protección para los medicamentos (CCP´s) y la patente de base
Los certificados complementarios de protección para los medicamentos (CCP´s) son un título nacional de propiedad industrial de carácter sui generis creado ex novo por el Reglamento (CEE) nº 1768/92 como mecanismo para compensar la reducción que, en la protección efectiva conferida por la patente, provoca el periodo que transcurre entre la presentación de la solicitud de patente y la autorización de comercialización del medicamento al que se refiere dicha invención.
Su objetivo esencial es garantizar una protección suficiente a las invenciones químicas y farmacéuticas a fin de incentivar la inversión en I+D+I en este sector, asegurando, en particular, al titular de esta clase de invenciones una exclusividad en el mercado durante un período que se prolongue más allá del período de validez de la patente.
Las condiciones que debe reunir un producto, tal y como se define en su artículo 1 del Reglamento, para obtener un CCP son a grandes trazos las siguientes (v. artículo 3 del Reglamento):
- que el producto esté protegido por una patente de base;
- que ese producto, como medicamento, haya obtenido una autorización de comercialización vigente en el Estado miembro para el que se solicite el certificado de conformidad con las Directivas comunitarias que regula en esta cuestión; y
- que esa autorización sea la primera en ese Estado miembro y que el producto no haya sido objeto ya de un certificado en el Estado miembro de que se trate.
El CCP produce sus efectos a partir de la extinción de la patente de base, a la que está íntimamente unida en aspectos tan relevantes como el alcance y contenido de la protección (v. artículo 4 y 5 del Reglamento), por un periodo igual al transcurrido entre la fecha de presentación de la solicitud de la patente de base y la fecha de la primera autorización de comercialización en la Comunidad, al que deben restarse 5 años. En todo caso, ese periodo, nunca puede ser superior a 5 años contados a partir de la fecha en la que el certificado surta efecto (vid. artículo 13 del Reglamento).
La patente de base EP ´066 y ES 891
En el caso que nos ocupa la patente de base del CCP en disputa tiene su origen en una patente químico y farmacéutica europea – EP ´066- (esto es: solicitada en la Oficina Europea de Patentes “OEP”, pero que posteriormente se convierte en tantas patentes nacionales como estados se han designado en la solicitud) solicitada antes de la entrada en vigor del ADPIC (que, según las SSTS de 26-X-2012 y 5-XII-2012 fue el 25 de enero de 1995) concedida con tres grupos diferentes de reivindicaciones en función de los distintos países para los que se había solicitado su concesión. En el caso del grupo entre el que se encontraba España ésta contenía sólo reivindicaciones de procedimiento, a diferencia de lo que sucedía con otro grupo de países que incluía también reivindicaciones de producto.
Naturalmente, el titular podría haber optado por presentar un juego único de reivindicaciones para todos los países designados. De haber sido así, la traducción del folleto de la patente europea al español que debe depositarse en la OPEM para que ésta deviniera eficaz en España, habría incluido también las reivindicaciones de producto, aunque debido a la Reserva formulada por España al amparo del artículo 167.2 a) del Convenio de Patente Europea (CPE) éstas no hubieran surtido efectos en nuestro país. Y ello, como es sabido, habida cuenta de que por virtud de esa Reserva (o de lo dispuesto en el Estatuto sobre Propiedad Industrial, la Disposición Transitoria 1ª de la antigua ley de Patente caso de tratarse de una patente española) las patentes solicitadas con anterioridad al 7 de octubre de 1992, cual es el caso que nos ocupa puesto que la patente fue solicitada el 1 de junio de 1986, no podían tener por objeto invenciones de productos químicos y farmacéuticos.
Ello no obstante, ha de advertirse que, a raíz de la recomendación contenida en la Comunicación del Presidente de la OEP de 13 de mayo de 1992, en la práctica los titulares de invenciones químico y farmacéuticas solía presentar juegos de reivindicaciones distintos para los países que se sumaron a la Reserva del artículo 167.2 a) del CPE y para el resto de países, en lugar de presentar un juego único de reivindicaciones para todos los países designados. La razón de ello se encuentra en que en esa recomendación se sugería a los titulares de patentes que presentaran un juego separado de reivindicaciones para evitar la publicación en España de reivindicaciones de producto químicos o farmacéuticos como tales. De ahí que, en el caso enjuiciado por la sentencia que analizamos, la actora decidiera presentar una solicitud de patente europea que designaba a España y que fue concedida con un juego de reivindicaciones específicas para nuestro país que no incluía reivindicaciones de producto.
Finalmente, la actora presentó ante la OEPM la (obligada) traducción al castellano de la patente europea que había de ser validada en España, la cual fue publicada 1 de mayo de 1995 con el número ES 2068891 (ES 891), y no contenía reivindicaciones de producto.
La fecha de entrada en vigor del Reglamento (CEE) nº 1768/92 en España
Las autoridades comunitarias estimaron oportuno establecer un régimen de aplicación del Reglamento (CEE) nº 1768/92 específico para aquellos estados en los que la posibilidad de patentar productos farmacéuticos hubiera sido introducida recientemente en su legislación, que consistió en retrasar cinco años su aplicación si su normativa vigente el 1 de enero de 1990 no contemplaba la posibilidad de patentar esos productos. Ese era precisamente y como hemos visto el caso de España, por lo que teniendo en cuenta que la entrada en vigor del Reglamento estaba prevista con carácter general para el 2 de enero de 1993 (vid. art. 23 del Reglamento), en nuestro país, devino aplicable desde el 2 de enero de 1998.
Y este calendario para nada podría entenderse modificado por las disposiciones del ADPIC relativas a la materia patentable y la protección de la llamada materia existente (arts. 27, 65.1 y 70 del ADPIC), por diversas razones de las cuales queremos destacar la siguiente: los CCP´s son una modalidad de propiedad industrial sui generis que no entra dentro del ámbito objetivo de aplicación del ADPIC, pues no se menciona entre las categorías de propiedad intelectual (en el sentido amplio que emplea el art. 1.2 del propio ADPIC) que abarca este Acuerdo y que son objeto de las secciones 1 a 7 de la Parte II, por lo que, obviamente, sus disposiciones no le son de aplicación.
Así las cosas, sólo a partir del 2 de enero de 1998, los titulares de productos protegidos por una patente en vigor, que hubieran obtenido dentro de los seis meses anteriores o a partir de esa fecha una primera autorización de comercialización podían solicitar el correspondiente CCP, cual es el caso enjuiciado. En particular, el CCP controvertido se solicitó, previa obtención de la autorización de comercialización, el 15 de julio de 2003 y fue concedido 14 de abril de 2004 y publicado dos días después.
La protección conferida por el CCP
A pesar de haberse configurado como un título de propiedad industrial distinto del de la patente de base, el CCP se encuentra estrechamente vinculado a ella. Buena muestra de ello es, por ejemplo, que la existencia de una patente en vigor que proteja el producto autorizado sea una de las condiciones para obtenerlo o que la fecha en que ésta caduca determine el inicio de sus efectos (v. respectivamente artículos 3 y 13 del Reglamento). Pero la conexión que media entre el CCP y la patente que le sirve de base se manifiesta de forma más elocuente aún y especialmente -aunque no sólo- en el objeto y contenido de la protección que éste otorga, pues se encuentra acotado tanto por la autorización de comercialización como por los límites de la protección que confiere la patente de base (v. artículo 4 del Reglamento). Así, desde la primera perspectivas, el CCP protege al producto amparado por la autorización de comercialización y, más concretamente, a las utilizaciones propias del sector farmacéutico cubiertas por la autorización antes de la su fecha de expiración dentro de los límites de la protección conferida por la patente de base. Desde la segunda óptica, la más relevante a efectos de esta nota, el certificado ampara el producto, como medicamento, tal y como está protegido por la patente de base (v. del artículo 4 del Reglamento y STJCE 16-IX-1999, asunto C-392/97 «Farmaitalia Carlo Erba Srl»). Y para delimitar el alcance de la protección que esta ofrece y, a falta de armonización comunitaria del sistema de patentes, es preciso acudir a lo dispuesto en la normativa que lo regula (v. STJCE 16-IX-1999, cit.) y, por tanto, en nuestro caso, atendiendo al contenido de las reivindicaciones (vid. art. 28 de la Ley de Patentes y 69 del Convenio de Patente Europea).
Así, pues, en el caso que resolvió la sentencia que examinamos, parece claro que, habida cuenta que la patente española 891, teniendo en cuenta sólo su traducción original, contenía sólo reivindicaciones de procedimiento (que no de producto) y que esa fue precisamente la patente de base del CCP, en tanto que los medicamentos genéricos controvertidos no las invadieran – lo cual fue negado por el tribunal a quo– su comercialización no constituía una infracción de la patente de base. Y sentado que el CCP atribuye a su titular idénticos derechos que los conferidos por la patente de base – dentro de los límites que ésta otorga (v. artículo 5 del Reglamento), tampoco el CCP en disputa.
La eventual validez de la ampliación del ámbito de protección del CCP fruto de la traducción revisada del folleto
Precisamente como vía para añadir las reivindicaciones de producto de las que la patente española 891, por las razones ya indicadas, carecía, la actora, con posterioridad a la solicitud y obtención del CCP, solicitó a la OEPM el depósito de una traducción revisada del folleto de la patente española 891 que incluía reivindicaciones de producto (las que contenía, en su solicitud cursada en la OEP, para un determinado grupo de países). Pese a que la OEPM lo denegó, ésta fue finalmente publicada en ejecución de la sentencia de Tribunal Supremo de 16 de septiembre de 2011.
Si esa traducción revisada ampliaba válidamente el ámbito de protección conferida por la patente de base 891 y, por ende, debido a las razones ya expuestas, el del CCP, para alcanzar las reivindicaciones de producto añadidas es la cuestión que debemos desentrañar.
Al respecto, el Tribunal Supremo advirtió, en primer término, que
“el artículo 70.7 del ADPIC legitima a la solicitante de una patente europea para cambiar el pliego de reivindicaciones de procedimiento previstas para su validación en España y sustituirlas por las reivindicaciones de producto solicitadas para el resto de los países no afectados por esta clase de reserva”.
Y comoquiera que el solicitante de la patente no hizo uso de esa facultad, porque la posterior validación de la patente europea en España se hizo mediante un pliego de reivindicaciones de procedimiento, el tribunal consideró que ello
“coloca(ba) a la patente en la misma situación respecto de la que se pronuncia el TJUE en la sentencia de 18 de julio de 2013 y en los dos autos de 30 de enero de 2014”.
y por tanto
“el Acuerdo ADPIC (y, en particular, añadimos sus artículos 27.1 y 70.2) no legitima para extender la protección de aquella patente a la invención del producto farmacéutico”.
En consecuencia, en la medida en que el Tribunal Supremo convino con el juzgador a quo, en que las reivindicaciones de producto incorporadas a la traducción revisada que la actora depositó carecían de eficacia, era obligado concluir que la comercialización en España de medicamentos genéricos que contenía el principio activo escitalopram no infringía patente de base de la actora ni, por ende, el CCP titularidad de la misma.
Esta solución alcanzada por el Tribunal es, a nuestro juicio, acertada, si bien creemos que para fundamentarla seguramente le habría bastado con recurrir al artículo 70.7 del ADPIC (precepto sobre el que la STS 16 de septiembre de 2011, que confirmó la procedencia de la nueva traducción de la patente, no se pronunció por razón de que para entonces se entendía que el ADPIC resultaba de aplicación en España a partir del 1 de enero de 1996) sin que seguramente fuera preciso aplicar la doctrina establecida por el Tribunal de Justicia de la Unión Europea en su sentencia de 18 de julio de 2013 y en los dos autos de 30 de enero de 2014. En efecto, es indiscutible que, tratándose, la patente europea del actor, de una patente solicitada antes y concedida después de la fecha de aplicación del ADPIC, el artículo 70.7 de este Acuerdo, le facultaba a modificarla para ampliar el pliego de reivindicaciones previstas para su validación en España e incluir las reivindicaciones de producto. Así se sigue, de su tenor según el cual
“en el caso de los derechos de propiedad intelectual cuya protección esté condicionada al registro, se permitirá que se modifiquen solicitudes de protección que estén pendientes en la fecha de aplicación del presente Acuerdo para el Miembro de que se trate para reivindicar la protección mayor que se prevea en las disposiciones del presente Acuerdo.
El único límite que el precepto establece estriba en que la protección no se amplíe a “materia nueva”, lo cual no parece que fuera el caso, puesto que en las invenciones farmacéuticas la modificación de la caracterización de la misma (mediante la inclusión de reivindicaciones de producto) puede hacerse sin que sea preciso ampliar la descripción de la invención, por lo que no se incumple el requisito según el cual las reivindicaciones deben fundarse en la descripción (v. artículo 28 de la Ley de Patentes).
Si la actora, pese a poder beneficiarse de esa posibilidad que les brindaba el artículo 70.7 del ADPIC no hizo uso de esa facultad, parece claro que no pueden solicitar después, a través de una traducción revisada del fascículo de la patente europea, esa ampliación de las reivindicaciones para incluir las de producto (v. J. Massaguer, «La protección de las invenciones de productos químicos y farmacéuticos mediante patentes solicitadas y concedidas con anterioridad a la fecha de aplicación del acuerdo sobre los trips», RDM, núm. 258, 2005, p. 1362 y A. Suñol, «Breves notas en torno a los certificados complementarios de medicamentos protegidos por una patente de base solicitada y concedida con anterioridad a la fecha de aplicación del ADPIC», La Ley, núm. 3, 2006). La doctrina del TJUE contenida en la sentencia de 18 de julio de 2013, asunto C?414/11 «Daiichi Sankyo/Demo», y en los dos autos de 30 de enero de 2014 (v. respectivamente asunto C-110/14 «Warner Lambert y cía vs Minerva» y asunto C-72/13 «Warner Lamber y cía vs Siegerpharma») que cambia el criterio que hasta entonces habían mantenido nuestros tribunales (v. ad ex. SSTS de 10-V-2011, y de 11-XI-2011) y que rechaza que por virtud de los artículos 27 y 70 del ADPIC una patente farmacéutica cuya solicitud contiene reivindicaciones tanto de procedimiento como de producto, pero que se concedió únicamente con las primeras, proteja, a partir de la entrada en vigor del Acuerdo, también a las reivindicaciones de producto, es en verdad y a nuestro juicio irrelevante para la correcta resolución del caso.
Ello no obstante, teniendo en cuenta, de una lado, que el TJUE aludió a los artículos 27 y 70 del ADPIC sin especificar que su doctrina fuera sólo de aplicación a los supuestos previstos en el apartado segundo del artículo 70; y, de otro lado, que en el caso de los ATJUE de 30 de enero de 2014, las patentes a las que se refería la cuestión prejudicial estaban pendientes de concesión (aunque no está muy claro si el TJUE lo advirtió) no parece del todo improcedente apoyarse, si quiera sea a fortiori, en la mencionada doctrina jurisprudencial del TJUE para respaldar el rechazo de la pretensión de la actora (eficacia de la inclusión de las reivindicaciones de producto en la traducción revisada del folleto) en el caso examinado en la sentencia comentada.
Aceptada la posibilidad de aplicar de las enseñanzas que se extraen de la jurisprudencia comunitaria ya citada no ofrece demasiadas dificultades convenir con el Tribunal Supremo en que no procedía, como el actor solicitaba, formular al TJUE una cuestión prejudicial para que esclareciese si esa doctrina jurisprudencial resultaba de aplicación a supuestos como el enjuiciado; esto es: la patentes que habían sido concedidas después de la entrada en vigor del ADPIC y, por tanto, no sólo a casos comprendidos en el artículo 70.2 del ADPIC sino también a los del artículo 70.7 ADPIC. La razón que sustenta esta conclusión es doble. En primer término, porque no es para nada obvio, habida cuenta de lo que hemos advertido en el párrafo anterior, que el apartado séptimo del artículo 70 del ADPIC quedara fuera del objeto de las cuestiones prejudiciales resueltas por la sentencia de 18 de julio de 2013 y los dos autos de 30 de enero de 2014. Y en segundo término y sobre todo, porque si conforme a la interpretación que el TJUE realiza de los artículos 27 y 70 del Acuerdo ADPIC en esos pronunciamientos no puede extenderse la protección de la patente concedida sólo con reivindicaciones de procedimiento a las reivindicaciones de producto, con mayor razón no ha de ser posible hacerlo en caso de tratarse de patentes que, como sucede en el supuesto que nos ocupa, aún no habían sido concedidas en el momento en que el ADPIC entró en vigor. Debe aplaudirse, pues, que nuestro Alto Tribunal, en esta ocasión, desoyera la petición de la parte y rechazar elevar una cuestión prejudicial al TJUE.