Por Jesús Alfaro Águila-Real
“La discriminación de precios lo explica todo”
Arnold Kling
La diferenciación de productos mediante prácticas engañosas realizadas de común acuerdo entre dos empresas es/puede ser un cártel de reparto de mercados
Discriminar, discriminar, discriminar
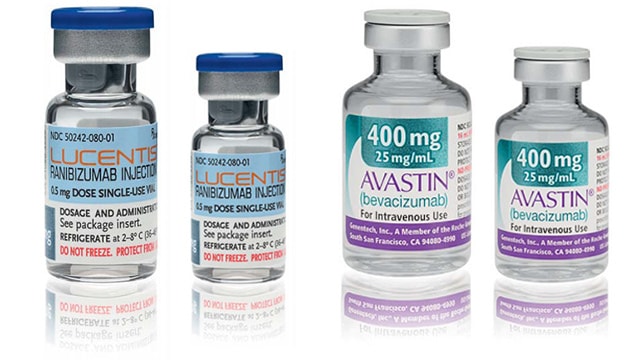
Roche, titular de una patente sobre un medicamento que podía ser utilizado eficazmente para tratamientos no incluidos inicialmente en la autorización comercial quiere maximizar los beneficios que extrae del medicamento cobrando un precio más elevado a los que lo usaban para tratar la enfermedad X que a los que lo usaban para tratar la enfermedad Y. Porque los enfermos de Y estaban “protegidos” por los límites de precios a los medicamentos establecidos por el gobierno nacional de turno. El truco para discriminar entonces consiste en vender el mismo medicamento bajo dos presentaciones y nombres comerciales distintos.
Pero, a veces, los fabricantes tienen mala suerte porque los médicos se adelantan y comienzan a utilizar para tratar X el medicamento puesto en el mercado por el fabricante para tratar la enfermedad Y, de modo que no es fácil convencerles de que, si el “nuevo” medicamento para tratar X es más caro que el que venían usando, dejen de usarlo. Siguen usándolo “off-label”. Para empeorar las cosas, el fabricante había licenciado el medicamento para el tratamiento de la enfermedad X, de modo que el licenciatario se queja de que las ventas no están alcanzando los niveles esperados ¡porque los médicos están prescribiendo el medicamento que comercializa el propio licenciante! Así que ambos se ponen de acuerdo para “convencer” a los médicos que los dos medicamentos no son iguales y que es peligroso utilizar el más barato para los tratamientos para los que el fabricante había puesto en el mercado el más caro. Pero interviene la autoridad de competencia cuando el sistema nacional de salud comprueba que las estratagemas del fabricante y del licenciatario estaban dando resultado y que la factura pagada por aquél había aumentado en 45 millones de euros al año por el trasvase de un medicamento a otro y es que la dosis de uno era hasta 40 veces más cara que la del otro.
El Derecho de la Competencia y el Derecho Farmacéutico pueden entrar en contradicción en estos casos, como explica el Abogado General en sus Conclusiones porque el segundo quiere que los precios bajen y el primero quiere asegurar que los medicamentos no se usen mas que para los tratamientos para los que han sido autorizados tras el complejo procedimiento de aprobación que garantiza la seguridad, inocuidad y eficacia de los medicamentos. Pero las cosas no son tan sencillas porque los fabricantes pueden “limitar la oferta” y no solicitar la autorización para su utilización en otras indicaciones si, como ocurre en el caso semejante de las importaciones paralelas, se pueden producir trasvases de clientes de uno a otro medicamento (como sucede cuando el bar de Gerona se suministra de Coca-cola fabricada en Polonia en lugar de la fabricada en Barcelona) o el fabricante se ve obligado a cobrar por el “nuevo” medicamento (el mismo bajo otra marca y para otros usos) lo mismo que por el “antiguo”. El Abogado General Saugmandsgaard Øe se da cuenta de la homogeneidad de las situaciones (v., puntos 111 ss de sus Conclusiones en este asunto)
Es la Sentencia del Tribunal de Justicia de la Unión Europea de 23 de enero de 2018 el tribunal ha dicho que hay que calificar como cártel un un acuerdo
… entre dos empresas que comercializan dos medicamentos competidores, que tiene como objetivo, en un contexto caracterizado por la incertidumbre científica, la difusión entre la Agencia Europea del Medicamento, los profesionales sanitarios y el público de información engañosa sobre los efectos adversos del uso de uno de esos medicamentos para el tratamiento de patologías no cubiertas por la AC de éste, con el fin de reducir la presión de la competencia resultante de dicho uso sobre el uso del otro medicamento.
El caso
Según la Autoridad de la Competencia italiana, “los grupos Roche y Novartis celebraron un acuerdo de reparto de mercado” consistente en “elaborar y difundir noticias que podían suscitar inquietud en el público (y distorsionar el resumen de sus características a efectos de obtener una autorización de la Agencia Europea del Medicamento),sobre la seguridad de un medicamento” (Avastin) si se utilizaba para el tratamiento de patologías de los ojos, de manera que la gente utilizara, para tales tratamientos otro medicamento (Lucentis) que, sin embargo, es exactamente el mismo (bioequivalencia). El objetivo del acuerdo entre Roche y Novartis era repartirse adecuadamente las ganancias de la comercialización de un medicamento asignando unas indicaciones (tratamientos tumorales) a Roche y otras (tratamientos oftálmicos) a Novartis.
Avastin, indicado inicialmente para las primeras indicaciones, se estaba utilizando ampliamente en Italia para las segundas, de manera que las ventas de Lucentis habían bajado estrepitosamente a favor de Avastin. Tras ponerse de acuerdo Roche y Novartis, las tornas cambiaron y se produjo una bajada en las ventas de Avastín y una subida de las de Lucentis con el efecto de provocar un sobrecoste para el servicio nacional de salud italiano de unos 45 millones de euros sólo en el año 2012.
¿Cómo se defendieron Roche y Novartis?
Alegaron que la patente del fármaco que se vendía bajo los nombres comerciales de Avastin y de Lucentis era de titularidad de una filial de Roche (Genentech) y que, por tanto, Roche podría haber impedido la entrada en el mercado de referencia por parte de Novartis, simplemente, distribuyendo ella misma el medicamento, de manera que – el que puede lo más ha de poder lo menos – si Roche podría haber negado a Novartis la licencia de su medicamento, también debería poder acordar con Novartis “que Roche no haría la competencia a Novartis, la licenciataria, en el mercado de referencia”, es decir, en el mercado de los tratamientos oftálmicos.
Antes de entrar en las preguntas que realiza el juez italiano al TJUE vale la pena destacar que la propia Autoridad de Competencia, entre otros, pidió al TJUE que no contestara a la cuestión prejudicial porque el juez italiano no había descrito adecuadamente los hechos del caso ni la argumentación de las partes. Parece que la autoridad no había acusado a Roche y Novartis de realizar conductas engañosas. Dice el Abogado General que la autoridd de competencia italiana “reprochó a las demandantes… haber pactado una estrategia de comunicación que… “consistía en insistir en los riesgos asociados al uso off–label del Avastin y a difundir afirmaciones relativas a la menor seguridad de ese producto respecto al Lucentis. En particular, (solicitar) a la Agencia Europea del Medicamento… una modificación del RCP de este producto y la autorización para enviar una (advertencia)… a los oftalmólogos”. Como decimos, a nuestro juicio, si la conducta de las empresas fuera intachable, el hecho de que se pusieran de acuerdo para llevar a cabo esas iniciativas no permite calificar de colusorio el acuerdo. Así lo considera también el Abogado General
cuando las afirmaciones divulgadas no son engañosas, estos comportamientos… no quedan comprendidos en el ámbito de la prohibición establecida en el artículo 101 TFUE, apartado 1 [letra b)]…
En este punto debemos criticar el uso del término “colusorio” para referirse a prácticas en el marco del art. 101. El Abogado General llama a tales conductas “colusorias” y la palabra colusorio significa “en perjuicio de terceros”, no simplemente, acuerdo. Por tanto, decir que un acuerdo es colusorio no es una redundancia pero decir que un acuerdo colusorio es un acuerdo prohibido por el art. 101.1 TFUE, sí que lo es. El Duden define kollusiv “unerlaubt zum Nachteil eines Dritten zusammenwirkend” y la RAE define colusión como “pactar contra un tercero”, es decir, contra los consumidores.
El TJUE contesta que ese no es su problema:
“corresponde exclusivamente al juez nacional, que conoce del litigio y que ha de asumir la responsabilidad de la decisión jurisdiccional que debe adoptarse, apreciar, a la luz de las particularidades del asunto, tanto la necesidad de una decisión prejudicial para poder dictar sentencia, como la pertinencia de las cuestiones que plantea al Tribunal de Justicia”. (A éste le corresponde sólo responder a) las cuestiones relativas a la interpretación del Derecho de la Unión planteadas por el juez nacional en el marco fáctico y normativo definido bajo su responsabilidad, y cuya exactitud no corresponde verificar al Tribunal de Justicia”… (las) cuestiones (planteadas)… tienen por objeto la interpretación del artículo 101 TFUE, se inscriben en el marco de un litigio relativo a la validez de una decisión mediante la que la AGCM aplicó el referido artículo. Por ello, esas cuestiones guardan una relación directa con el objeto del litigio y no son hipotéticas.
Definición del mercado relevante en el caso de medicamentos
si el artículo 101 TFUE debe interpretarse en el sentido de que, a efectos de su aplicación, una autoridad nacional de defensa de la competencia puede incluir en el mercado de referencia, además de los medicamentos autorizados para el tratamiento de las patologías de que se trate, otro medicamento cuya Autorización (AC) no cubre dicho tratamiento, pero que se usa con ese fin.
El TJUE contesta afirmativamente porque
“El mercado de productos de referencia comprende la totalidad de los productos y servicios que los consumidores consideren intercambiables o sustituibles en razón de sus características, su precio o el uso que se prevea hacer de ellos… el hecho de que los productos farmacéuticos se fabriquen o vendan de manera ilícita impide, en principio, que se consideren sustituibles o intercambiables… habida cuenta, en particular, de los riesgos para la salud pública que generan para los profesionales sanitarios y los pacientes…
Sin embargo… el Avastin (estaba)…. cubierto por una AC válidamente concedida por la Comisión, sobre la base del referido Reglamento, para el tratamiento de patologías tumorales.
El litigio principal atañe al uso del Avastin para tratar patologías oculares que no estaban cubiertas por esa AC… En efecto, Roche alega en relación con este aspecto que una gran parte, o incluso la mayoría, del Avastin destinado a ser utilizado al margen de su AC en Italia fue reacondicionado en serie, sin autorización de fabricación, y vendido a los prestadores de servicios sanitarios por anticipado, antes de que presentasen recetas individuales.
(Pero)… la Directiva 2001/83 no prohíbe que los medicamentos sean utilizados para indicaciones terapéuticas que no están cubiertas por su AC. En efecto, el artículo 5, apartado 1, de la Directiva 2001/83 establece que los Estados miembros podrán, con vistas a atender necesidades especiales, excluir del ámbito de aplicación de la Directiva a los medicamentos que se suministren atendiendo a una solicitud de uso compasivo, elaborados de acuerdo con la prescripción de un facultativo reconocido y que los destine a un paciente individual bajo su responsabilidad personal directa… (Por otra parte…) El reacondicionamiento del Avastin para su uso en el ámbito de la oftalmología requiere, en principio, una autorización, salvo si esta operación se realiza únicamente con vistas a su despacho al por menor por farmacéuticos en un laboratorio o por otras personas legalmente autorizadas en los Estados miembros De estos elementos se desprende que la normativa de la Unión en materia de productos farmacéuticos no prohíbe ni la prescripción de un medicamento al margen de su AC ni su reacondicionamiento con vistas a tal uso, pero supedita estas acciones al cumplimiento de una serie de requisitos definidos en dicha normativa.
(Sin embargo)… la comprobación de la conformidad con el Derecho de la Unión de las condiciones en las que un medicamento es… prescrito por los médicos y… reacondicionado con vistas a su uso al margen de su AC, no incumbe a las autoridades nacionales de defensa de la competencia. Ese tipo de comprobación sólo puede ser realizada de modo exhaustivo por las autoridades competentes para controlar el cumplimiento de la normativa farmacéutica o por los órganos jurisdiccionales nacionales.
De modo que la autoridad de competencia puede y debe limitarse a comprobar que así haya sido. Como dijo el Abogado General, no puede perderse de vista que la autorización de comercialización está limitada por la solicitud presentada, de manera que “esta solicitud no agota necesariamente los usos posibles del medicamento en cuestión por los médicos en ejercicio de su libertad terapéutica”. Esta consideración es muy importante desde el punto de vista de la competencia. No puede equipararse, en este sentido, el uso off-label de un medicamento por los médicos a un uso ilícito en el sentido relevante para el Derecho farmacéutico que está orientado por principios que no se ponen en riesgo significativo por los usos off-label que son objeto del caso. Citamos de nuevo al Abogado General: se daría “carta blanca – a los fabricantes de medicamentos – para ponerse de acuerdo, en la fase anterior a la comercialización de sus medicamentos, para repartirse los mercados excluyendo todo solapamiento de indicaciones terapéuticas comprendidas por sus respectivas solicitudes de autorización comercial”
De ahí que sea sensata la aproximación del tribunal – siguiendo al Abogado General – que pone la carga de la argumentación en el que alegue la ilicitud
… ningún elemento de los autos sugiere que, cuando la AGCM aplicó el artículo 101 TFUE, las autoridades competentes para controlar el cumplimiento de la normativa farmacéutica o los órganos jurisdiccionales nacionales hubiesen constatado el eventual carácter ilícito, alegado por Roche, de las condiciones de reacondicionamiento y de prescripción del Avastin destinado a ser utilizado al margen de su AC.
… Al contrario… cuando se adoptó dicha decisión, la EMA y la Comisión no habían estimado la solicitud de Roche dirigida a que se incluyesen en la lista de «reacciones adversas» que figura en el resumen de las características del Avastin determinadas consecuencias adversas derivadas de la utilización intravítrea de ese medicamento y consideraron que tales consecuencias únicamente justificaban una mención entre las «advertencias especiales y precauciones de empleo»….
Como dijo el Abogado General “no corresponde a las empresas prejuzgar esta ilicitud eliminando de forma concertada, por medio de la difusión de noticias engañosas, la presión competitiva que estas actividades ejercen sobre las ventas de otros productos”
En estas circunstancias, la autoridad de competencia puede determinar como mercado relevante el que incluía Avastin y Lucentis lo que es especialmente razonable si se tiene en cuenta que, a efectos del control de concentraciones y de determinar la existencia de una posición dominante en el sector de los medicamentos, el criterio que se ha utilizado normalmente es el de que los medicamentos
“que puedan servir para las mismas indicaciones terapéuticas, ya que los médicos prescriptores se guían principalmente por consideraciones de oportunidad terapéutica y de eficacia de los medicamentos”.
En conclusión, como lo relevante es la sustituibilidad y Avastin y Lucentis son sustitutivos la Autoridad de Competencia hizo bien en considerar que formaban parte del mismo mercado.
una autoridad nacional de defensa de la competencia puede incluir en el mercado de referencia, además de los medicamentos autorizados para el tratamiento de las patologías de que se trate, otro medicamento cuya AC no cubre dicho tratamiento, pero que se utiliza con ese fin, y guarda, por tanto, una relación concreta de sustituibilidad con los primeros. Para determinar si existe esa relación de sustituibilidad, dicha autoridad debe, en el supuesto de que las autoridades o los órganos jurisdiccionales competentes para ello hayan realizado un examen de la conformidad del producto en cuestión con las disposiciones aplicables que regulan su fabricación o su comercialización, tener en cuenta el resultado de dicho examen, evaluando sus eventuales efectos en la estructura de la oferta y la demanda.
En este punto, permítaseme un pequeño excurso. El Abogado General dice, con gran precisión, que el Avastin ejercía una presión competitiva efectiva sobre el Lucentis “cuando era utilizado off-label” por los médicos para tratar enfermedades vasculares de los ojos (Wettbewerbsdrück en la traducción alemana, “competitive constraint” – no “restraint”, en la inglesa) pero en la traducción española de las conclusiones se habla de “restricción de la competencia” con lo que se viene a decir lo contrario de lo que pretendía el Abogado General. Este quiere decir que dos productos forman parte del mismo mercado si son sustitutivos y son sustitutivos si uno ejerce presión competitiva o constriñe lo que el titular del otro producto puede hacer en el mercado (subir precios o reducir la oferta) porque, ante una subida del precio, los consumidores se dirigirán al producto sustitutivo. De la descripción de los hechos resulta con claridad que Avestin era sustitutivo de Lucentis para el tratamiento de las enfermedades vasculares de los ojos por lo que ambos eran parte del mismo mercado.
Carácter colusorio del acuerdo entre Roche y Novartis
El TJUE no se ocupa de decidir si Roche y Novartis eran o no competidores. La cuestión es relevante porque, a mi juicio, en el art. 101 TFUE no pueden estar incluidos los acuerdos entre empresas que no sean, al menos potencialmente, competidoras entre sí. Si no hay competencia entre ellas, no hay competencia que pueda ser restringida. El Abogado General, sin embargo, resuelve la cuestión: hay pocas dudas de que Roche y Novartis son competidoras, en general, y al menos potencialmente en el mercado de productos para enfermedades de los ojos. Por tanto, el acuerdo entre ambas – aunque sea de licencia – y aunque sea un acuerdo entre dos empresas que, en relación con el objeto del acuerdo, están situadas en dos niveles distintos de la cadena de producción y distribución (uno es el titular del medicamento y el otro es un distribuidor-fabricante en su caso), es un acuerdo entre empresas competidoras. Y las restricciones de la competencia que deben preocuparnos son “horizontales”, no verticales (respecto de las verticales, el Abogado General explica correctamente que las que deben preocuparnos son las “intermarcas” que, en el caso de los acuerdos de licencia, son las “intertecnología”, no las “intratecnología”. Esto quiere decir, simplemente que el dueño de una tecnología, como el dueño de un producto debe poder decidir libérrimamente como distribuye éste). Aplicado al caso, la comercialización del principio activo bajo una sola marca comercial – Avastin – hubiera impedido a Roche obtener un precio mayor de los enfermos que lo utilizaban para el tratamiento de enfermedades vasculares de los ojos. Recuerden, discriminar es muy difícil, casi nunca puede lograrse por las empresas de modo efectivo.
El Tribunal empieza diciendo algo que contradice el concepto tradicionalmente sostenido por la jurisprudencia europea de conducta restrictiva de la competencia, concepto que comenzó a abandonarse en el asunto Cartes Bancaires. El TJUE cita su sentencia MasterCard y otros/Comisión C-382/12 apartado 89 para apoyar la siguiente afirmación
si una operación o una actividad determinada no está comprendida en (la)prohibición (d)el artículo 101 TFUE, apartado 1, por su neutralidad o por su efecto positivo en el ámbito de la competencia, una restricción de la autonomía comercial de uno o varios de los participantes en dicha operación o actividad tampoco está comprendida en dich(a prohibición) si tal restricción es necesaria objetivamente para llevar a cabo la mencionada operación o actividad y proporcionada a los objetivos de una u otra
Obsérvese que el TJUE está aceptando que la “restricción de la autonomía comercial” no es el criterio que permite determinar si estamos ante una restricción de la competencia que caiga bajo el art. 101.1 TFUE. Como ya dijera nada menos que en 1904 el Tribunal Supremo norteamericano, si el criterio para determinar que estamos ante una restricción de la competencia fuera la limitación, mediante un acuerdo, de la libertad de actuación en el mercado de las empresas que son partes del acuerdo todos los contratos celebrados entre dos empresas independientes serían restrictivos de la competencia, porque, por definición, cuando alguien celebra un contrato obligatorio, se obliga a hacer algo, a no hacer algo o a entregar algo a alguien, con lo que, automáticamente, está limitando su “autonomía comercial”.
Al tiempo, el TJUE acepta la aplicación en Derecho Europeo de la idea de
las “restricciones accesorias” (ancillary restraints),
esto es, la idea de que si el contrato celebrado entre las partes no es restrictivo de la competencia porque el objetivo que persiguen las partes es legítimo, tampoco pueden serlo las restricciones de la competencia que se incluyan en el mismo y que sean necesarias para que las partes puedan lograr los objetivos perseguidos al celebrar el contrato.
En efecto, cuando no es posible disociar tal restricción de la operación o la actividad principal sin comprometer la existencia y los objetos de éstas, se debe examinar la compatibilidad de dicha restricción con el artículo 101 TFUE conjuntamente con la compatibilidad de la operación o de la actividad principal de la cual es accesoria, y ello aun cuando, tomada de forma aislada, dicha restricción pudiera parecer, a primera vista, comprendida en (la)… prohibición del artículo 101 TFUE, apartado 1 (sentencia de 11 de septiembre de 2014, MasterCard y otros/Comisión, C?382/12 P, EU:C:2014:2201, apartado 90)… (A tal efecto)… debe averiguarse si sería imposible llevar a cabo dicha operación sin la restricción en cuestión.
Introduce, en este punto, una restricción que, bien entendida, es correcta pero que puede dar lugar a excesos prohibitivos por parte de las autoridades nacionales si no se interpreta estrictamente:
Por el hecho de que dicha operación sólo sería más difícilmente realizable, o generaría menos beneficios sin la restricción en cuestión, no puede considerarse que dicha restricción tenga el carácter de objetivamente necesaria exigido para ser calificada de accesoria. En efecto, tal interpretación llevaría a ampliar dicho concepto a restricciones que no son estrictamente imprescindibles para llevar a cabo la operación principal. Ese resultado sería contrario al efecto útil de la prohibición prevista en el artículo 101 TFUE, apartado 1 (sentencia de 11 de septiembre de 2014, MasterCard y otros/Comisión, C?382/12 P, EU:C:2014:2201, apartado 91).
Creemos que el TJUE es demasiado estricto. Para que una restricción accesoria sea legítima basta con que sea adecuada y necesaria para que las partes logren óptimamente los beneficios que persiguen a través de la celebración del contrato – lícito –. Por tanto, no hace falta que la restricción de la competencia sea “estrictamente imprescindible”. Basta con que los beneficios –legítimos- perseguidos por el acuerdo no puedan obtenerse con la misma eficacia si no se incluye la restricción de la competencia en el contrato.
Difundir informaciones engañosas no puede estar amparado por la doctrina de las restricciones accesorias
El Tribunal de Justicia, siguiendo al Abogado General descarta que nos encontremos ante restricciones accesorias fundamentalmente porque no es que Roche estuviera imponiendo a Novartis limitaciones a lo que podía hacer con el producto licenciado. Es que ambas partes del contrato de licencia se habían puesto de acuerdo para influir sobre terceros al contrato (los prescriptores).
… la difusión de información… engañosa sobre los efectos adversos del Avastin en caso de administración de dicho medicamento para el tratamiento de patologías oculares, tenía como objetivo limitar, no la autonomía comercial de las partes del contrato de licencia relativo al Lucentis, sino los comportamientos de terceros y, en particular, de los profesionales sanitarios, con el fin de lograr que el uso del Avastin para este tipo de tratamiento dejara de provocar una reducción del uso del Lucentis para esos mismos fines.
Por otra parte, aunque es cierto que los autos en poder del Tribunal de Justicia no incluyen ningún elemento que permita poner en duda el carácter favorable o, al menos, neutro para la competencia del contrato de licencia celebrado entre Genentech y Novartis, no puede considerarse que un comportamiento como el descrito en el apartado precedente haya sido objetivamente necesario para la aplicación del referido contrato. En efecto, ese comportamiento no se acordó en el contrato, ni siquiera con ocasión de la celebración del mismo, sino varios años después de su celebración, con el fin de frenar la sustituibilidad creada, en particular, por las prácticas de prescripción de los médicos, entre el uso del Avastin y el uso del Lucentis para el tratamiento de patologías oculares… que el comportamiento sancionado tuviese por objeto… hacer más rentable la explotación por Novartis del Lucentis no puede… llevar a (afirmar) que… era objetivamente necesario para la aplicación del contrato de licencia.
Ergo, el acuerdo para realizar esas afirmaciones públicas engañosas encaja en el art. 101.1 TFUE en la medida en que restringe la competencia. Obsérvese que el hecho de que las afirmaciones de ambas y la solicitud ante la AEM fueran engañosas es muy relevante. No creo que pudiera hablarse de prácticas colusorias si ambas compañías, para maximizar los ingresos que obtenían de la explotación separada del medicamento en los distintos tratamientos hubieran utilizado estrategias acordadas pero lícitas. Por ejemplo, hubieran podido demostrar que, efectivamente, era arriesgado utilizar el Avastin en el tratamiento de las enfermedades vasculares de los ojos o que la presentación del Avastín impedía su utilización mediante una inyección que es la única posible para tales tratamientos.
Queda por determinar si
se trata de una restricción por el objeto o por los efectos
La respuesta a esta cuestión va siendo cada vez más fácil. En realidad, lo que hay que preguntarse es si estamos o no ante un cártel. Y así planteado, no es difícil concluir que Roche y Novartis habían acordado repartirse el mercado del medicamento reservando al primero los pacientes tumorales y al segundo los pacientes oculares, utilizando las autorizaciones comerciales y las denominaciones comerciales de los medicamentos y la estrategia de comunicación engañosa para lograr efectivamente el reparto de mercado. Como los médicos italianos (y los farmacéuticos) no les siguieron en su estrategia lícita, tuvieron que ponerse de acuerdo para encontrar otras vías más dudosamente lícitas que les permitieran asegurarse el reparto de las rentas de la venta del medicamento que habían pactado en el contrato de licencia. O sea, que la respuesta es que, en principio,
estamos ante un cártel de reparto de mercados y si no se trata de un cártel de chichinabo,
esto es, si el acuerdo es idóneo para afectar de forma mínimamente significativa a la competencia en algún mercado relevante, la conducta debe ser sancionada como infracción por el objeto, esto es: debe ser prohibida; el acuerdo declarado nulo y las partes del acuerdo multadas, con independencia de los efectos concretos que sobre el mercado concreto haya tenido el acuerdo.
El TJUE comienza recordando la doctrina sentada en Cartes Bancaires y, en el caso de los medicamentos, las peculiaridades derivadas de la intensa regulación de estos productos por parte del Derecho europeo y nacional. En el caso, lo interesante – como ocurre, en un sentido diferente, con el caso de la manipulación del Libor – es que las conductas de Roche y Novartis
adoptar una estrategia común destinada a contrarrestar la presión de la competencia ejercida sobre las ventas del Lucentis por el uso del Avastin para el tratamiento de patologías oculares que no estaban comprendidas en la AC de éste,
podía ser una conducta ilícita de acuerdo con la legislación europea y nacional sobre medicamentos, por lo que se plantea el problema del bis in idem y si el control por las autoridades sectoriales debe prevalecer sobre el control de las autoridades de competencia cuando ambas actúan – como es el caso – no como reguladores sino como vigilantes del mercado. Aunque no podemos ocuparnos aquí de esa cuestión, en un caso como éste, probablemente, unas (Derecho farmacéutico) y otras (Derecho de la Competencia) normas tienen finalidades diferentes lo que facilita su aplicación simultánea.
La conducta colusoria
tenía como objetivo crear una diferenciación artificial entre esos dos medicamentos manipulando la percepción de los riesgos asociados al uso del Avastin para el tratamiento de las referidas patologías mediante la elaboración y difusión de noticias, apoyándose en una interpretación «alarmista» de los datos disponibles, que pudiera generar en el público preocupación por la seguridad de determinados usos del Avastin e influir así en las decisiones terapéuticas de los médicos, y minusvalorando los conocimientos científicos de sentido contrario.
… la colusión también tenía por objeto transmitir a la EMA información que pudiera amplificar la percepción de los riesgos asociados a ese uso con el fin de conseguir una modificación del resumen de las características del Avastin y la autorización de remitir a los profesionales sanitarios una carta destinada a advertirles de esos efectos adversos. … la EMA y la Comisión no estimaron la solicitud de Roche dirigida a que se incluyese en la lista de «reacciones adversas» que figura en el resumen de las características del Avastin determinadas consecuencias adversas derivadas de la utilización intravítrea de ese medicamento y consideraron que tales consecuencias únicamente justificaban una mención entre las «advertencias especiales y precauciones de empleo».
… , el hecho de que dos empresas que comercializan productos farmacéuticos competidores se pongan de acuerdo para difundir información referente específicamente al producto comercializado por una sola de ellas puede constituir un indicio de que esa difusión persigue objetivos ajenos a la farmacovigilancia.
… es previsible que la difusión de información de tales características incite a los médicos a renunciar a prescribir el referido medicamento, provocando así la disminución esperada de la demanda para ese tipo de uso. La transmisión de información engañosa a la EMA, a los profesionales sanitarios y al público constituye además, tal como se desprende de los apartados 84 a 87 de la presente sentencia, una infracción de la normativa farmacéutica de la Unión que da lugar a sanciones
En estas circunstancias, debe considerarse que… tiene un grado de nocividad para la competencia suficiente para que resulte superfluo el examen de sus efectos….en el sentido de que constituye una restricción de la competencia «por su objeto»
Conclusión
El TJUE «progresa adecuadamente» en el camino hacia la construcción de un Derecho de la Competencia europeo sistemática y valorativamente coherente con el objetivo de controlar el ejercicio de poder de mercado.
¿Le interesan estos contenidos?
Suscríbase a nuestra newsletter para recibir mensualmente los nuevos contenidos, noticias, invitación a debates, clases y eventos.
Se ha suscrito a nuestros contenidos, muchas gracias.
*Al suscribirse acepta automáticamente nuestra política de privacidad.